海水と河川の循環
地球を循環する水には
海水、河川水、地下水、雨水など
様々な形態があります。
それぞれの特徴をもち、
それぞれの役割を果たし、人間や生き物は
その恩恵を受けながら暮らしています。
自然の中の水について、
分類しながら考えてみましょう。
最も安定している
命のゆりかご・海
海水には80種類以上の元素が溶け込んでいます。
海水中の主要元素を記すと、
水素、酸素、塩素、ナトリウム、マグネシウム、硫黄、窒素、カルシウム、カリウム
となります。同様に人間の体液の主要元素を記すと、水素、酸素、炭素、窒素、ナトリウム、カルシウム、リン、硫黄、カリウム、塩素、マグネシウムとなり、海水の成分と良く似ていることがわかります。生物が海から生まれたと考えられるゆえんです。
海は地球上の約3分の2を覆うほど広いのですが、主要成分は全海洋でほぼ同じ。しかもそれは38億年変わっていないと考えられています。
一方で、毎日大量に海に入る河川水には炭酸水素イオンとカルシウムイオンが多く含まれており、世界中で大量の炭酸水素イオンとカルシウムイオンが海に入っていることになります。ところが海水の成分を見るとこの二つの成分量は少なくなっています。これはどうしてなのでしょうか。
海に入り込む炭酸水素イオンとカルシウムイオンを除く役割をしているのが表層水(※1)にいるプランクトン、さんごや貝類です。これらの生物が炭酸カルシウムの殻を作ることで、河川から入った主要の2成分は取り除かれているのです。また同様に、ケイ藻などはオパール状シリカの殻をつくることで、ケイ素イオンを固定します。さらに、栄養塩である窒素、リンなどは同じく表層水で植物プランクトンにより摂取されて取り除かれるのです。
- 水深200メートル以内の水
また、海は二酸化炭素を吸収する場でもあり、現在地球温暖化で大問題になっている炭素循環の、主役を担っています。排出される二酸化炭素290億トンのうち90億トンを、海が溶かして吸収していると言われています。
地球をつくる
材料を運ぶ・河川水
河川は、陸から海へさまざまな物質を運ぶパイプのようなものです。地殻を構成する岩石成分や、人間の活動から出された化学物質を溶かしこみ、土壌の微小な粒をそのまま混ぜ込んで海へと運んでいます。
海へ運ばれた物質は海底に沈殿堆積し、新たな資源をつくるもとになります。
日本の川の水の平均的な主要化学成分は、炭酸水素イオン、塩化物イオン、硝酸イオン、ケイ素イオン(溶存ケイ酸)、硫酸イオン、カルシウムイオン、ナトリウムイオン、マグネシウムイオン、カリウムイオン、アンモニアイオンです。外国の河川と比較して、カルシウムイオン、マグネシウムイオンの濃度が低く、ケイ素イオン(溶存ケイ酸)の濃度が大きいのが特徴です。これは日本に多く分布する火山系地質がケイ酸を多く含むためです。
川は人間の活動によってもたらされた汚染物質も同様に運搬していますが、自浄作用も持っています。にごりをつくる小さな粒子は流れるに従って沈殿し、土壌の粘土や岩石に接触することで取り除かれる成分もあります。また有機物の一部は微生物や太陽光によって分解されます。
また、河口付近で海水と混ざり合い、干満にしたがってゆっくりと行ったり来たりしているうちに、粘土鉱物や岩石の粒などは、自重により沈殿します。河川水に溶けていた成分も海水と混ざって沈殿するものもあります。また、プランクトンや有機物の一部は、河口付近に大量に生息するアサリなどの2枚貝によって摂取され、取り除かれます。アサリが入水管から水を吸い込むときに、多くの懸濁物を吸い込み、えらでろ過したのち、消化管へ送り消化します。ろ過されて懸濁物の少なくなった水は、体外へ排出されます。これを繰り返すうちに懸濁物は次第に減り、水は澄んでくるのです。また、アサリなどが出した糞は、さらに底にすむバクテリアや線虫類、有孔虫、ソコミジンコなどが摂食してさらに分解が進みます。
大地に磨かれた
水・地下水
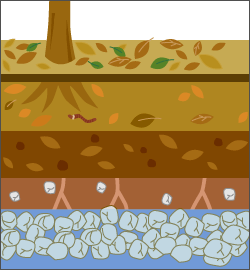
地上に降ってきた雨水は、土の表面からしみ込んで、徐々に地下へ浸透していきます。土壌内に入り込んだ水は、ゆっくりと浸透しながら土壌をうるおし、やがて地下水面に到達します。その後湧水として湧き出たり、井戸水としてくみ上げられたりします。
水は地下へ至る過程で、主に土壌や地層といった天然のろ過装置によってろ過されます。
雨水は、空気中のちりやほこりなどの粒状物質、硫黄・窒素酸化物・炭酸などの溶存物質を含み、弱酸性になっています。地面に落ちた雨水は、土壌の中の大小さまざまなすき間を通るうちに、ちりやほこりはろ過されて取り除かれます。溶存物質は土壌物の微生物による摂取、植物による吸収、土壌への吸着などにより取り除かれます。その後、土壌の下にある砂礫層に浸透して通過する際に、土壌を通過した微小な粒子はさらにろ過されます。
このようなプロセスを経て、水は浄化され、地下水脈に到着します。また、地下水が最も長い時間とどまっている岩石帯からは、水を媒介とした化学的風化作用により、岩石から溶出したさまざまなミネラル分を供給され、これがミネラルウォーターと呼ばれる水になるのです。
地下水を見る試み「GETFLLOWS(ゲットフローズ)」
サントリーは、様々な専門家と協働で、地下の水の流れを知り、シミュレーションするためのモデリングシステム「GETFLLOWS」の開発を進めています。
夫々の環境における相応しい水の使い方や、どのような森林整備が未来の地下水のためにより良いのかなどを考えるための大きな道標となります。
雨水
雨水は海から蒸発した水蒸気が凝結したものですが、大気中の二酸化炭素やその他の大気成分、ちりなどをとりこんで、pH(※2)5.6~5.7の弱い酸性になっています。
※2:ピーエイチ。水の酸性・中性・アルカリ性をあらわす。pH1は強い酸性、pH14が強いアルカリ性、その中間のpH7は中性ということになる。
これに工場や車の排気ガスから出される硫黄酸化物や窒素化合物によってもたらされる硫酸や硝酸が溶けると、雨はさらに強い酸性を示すようになります。一般にpH5.6以下の雨を酸性雨と呼んでいます。酸性雨による影響として、森林の立ち枯れ、湖沼の酸性化、土壌の酸性化、建造物の劣化などが問題になっています。
参考文献
- 北野康/著 『新版 水の科学』 日本放送出版協会
- 小倉紀雄・一國雅己/共著 『環境化学』 裳華房
- J.Eアンドリューズ P.ブリンゴリム T.D.ジッケルズ P.S.リス B.J.リード/著 渡辺正/訳 『地球環境化学入門』 シュプリンガー・フェアラーク東京
- 有田正光/編著 池田裕一・中井正則・中村由行・道奥康治・村上和男/著 『水圏の環境』 東京電機大学出版局
- 角皆静男・乗木新一郎/著 西村雅吉/編著 『海洋化学』 産業図書株式会社
- 柳哲雄/著 『海の科学 -海洋学入門 第2版』 恒星社厚生閣
- W.S.ブロッカー/著 新妻信明/訳 『海洋科学入門』東京大学出版
くらしと水
私たちの毎日に欠かせない水。
今日から役立つ、くらしの水知識をご紹介します。
世界の水文化
地域の気候や状況によって、人々と水との付き合いは様々。世界各地の特徴的な水の活用をご紹介します。
水の科学
ひと言で「水」と言っても、実は色々な側面が。水の性質や種類、生命と水との関係を解き明かします。